Нильский синий и бенгальский розовый: создан тераностический препарат против рака

В Московском физико-техническом институте (МФТИ) создали наночастицы, которые способны распознать раковые клетки в организме, «подсветить» их, а затем уничтожить. Основное преимущество разработки — полная биосовместимость.
Проблема химиотерапии — относительная неспецифичность препаратов: низкомолекулярные соединения, антибиотики или другие вещества, вызывают гибель раковых клеток, но также воздействуют на здоровые. Среди серьезных побочных эффектов — поражение печени, почек, селезенки. Один из самых популярных химиотерапевтических препаратов, доксорубицин, кардиотоксичен: его прием может привести к серьезным нарушениям в работе сердца.
Лаборатория биохимических исследований канцерогенеза МФТИ работает над тем, чтобы снизить побочные эффекты за счет доставки препарата непосредственно в область опухоли, без контакта со здоровыми органами.
«Мы разрабатываем такие формуляции, которые обладают пониженной системной токсичностью и повышенным связыванием с раковыми клетками, — рассказывает заведующая лабораторией Виктория Шипунова. — Химиотерапевтические соединения инкапсулируются в наноносители, поверхность которых оснащена распознающими молекулами».
Узнать раковую клетку
Последняя разработка МФТИ — тераностический (обеспечивающий одновременно диагностику и лечение) препарат из наночастиц сополимера молочной и гликолевой кислоты. Антитела на наночастицах узнают раковые клетки по специфическому рецептору HER2.
«Раньше распознающие молекулы «пришивали» к поверхности наночастицы посредством сложных химических реакций. У нас более грубый метод синтеза: по сути, мы смешиваем все в одном «горшке» и очищаем от непрореагировавших реагентов, — объясняет Виктория Шипунова. — Звучит не супер-изящно, но этот способ гораздо удачнее может быть транслирован в биотехнологическое производство, когда необходимо получить воспроизводимость частиц от партии к партии. У нас более воспроизводимый синтез, то есть мы решили одну из самых важных проблем в этой области, которая препятствует вводу адресных наноформуляций в клиническую практику».
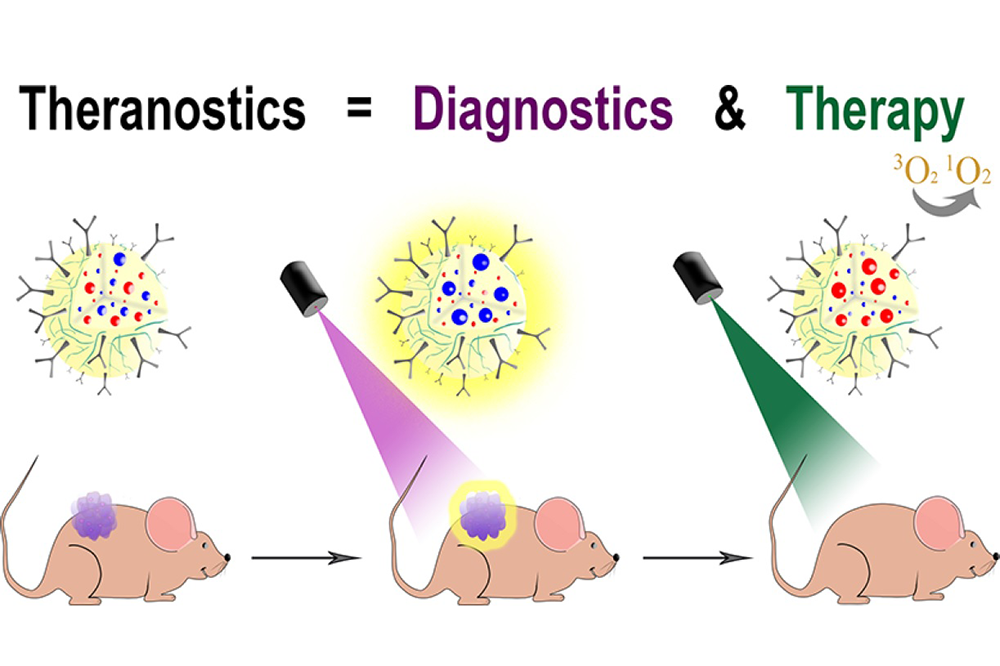
Подсветить и уничтожить
Внутри каждой наночастицы — биосовместимый краситель нильский синий и фотосенсибилизатор бенгальский розовый. Нильский синий, попадая в раковые клетки, под воздействием красного света флуоресцирует и тем самым помогает определить очаг болезни. Светится он только внутри клетки: пока наночастицы в кровотоке, флуоресценциях у них крайне слабая, это объясняется сольватохромной природой красителя.
«Соединение стоит недорого и уже давно применяется в стандартных процедурах молекулярной биологии, когда надо окрасить какие-либо вещества, — говорит Виктория Шипунова. — Однако почему-то оно никогда не рассматривалось как удобный диагностический инструмент. В отличие от традиционных флуоресцентных частиц, например квантовых точек, нам не надо ждать, пока они полностью выведутся из кровотока, чтобы проводить диагностику, так как отсутствует фоновая флуоресценция от кровотока».
Бенгальский розовый под воздействием ярко-зеленого света генерирует активные формы кислорода, которые вызывают гибель раковых клеток.
Проверка на мышах
Препарат МФТИ полностью биосовместимый и биодеградируемый. Молочная и гликолевая кислоты, из которых состоит сополимер матрицы, в большом количестве содержатся в организме человека. Наночастицы не обладают токсичными свойствами и полностью разлагаются в течение полугода.
Ученые уже провели доклинические испытания на мышах — результаты говорят об эффективности разработки. «Мы вылечили всех пятерых «пациентов». Они еще год наблюдались у нас в состоянии полной ремиссии — ни новых опухолей, ни метастаз. Потом все пятеро даже пошли участвовать в другом эксперименте», — рассказывает Виктория Шипунова.
СПРАВКА
Лаборатория канцерогенеза МФТИ изучает механизмы возникновения и развития агрессивных опухолей, а также ищет пути максимально эффективного предотвращения этих процессов. Междисциплинарные исследования на стыке молекулярной и клеточной биологии, биофизики, биомедицины, нанобиотехнологий направлены на фундаментальное изучение механизмов канцерогенеза на молекулярно-генетическом, клеточном, органо-тканевом уровнях и на уровне целого организма.







