Засветить бактериям: разработка МИФИ поможет ускорить заживление ран
Фотодинамическая терапия как способ борьбы с патогенными микроорганизмами применяется давно. Ученые кафедры лазерных микро-, нано- и биотехнологий Инженерно-физического института биомедицины Национального исследовательского ядерного университета «МИФИ» сделали новый шаг в этом направлении. Их разработка не просто убивает мешающие затянуться ранам бактерии, но и помогает врачам оценить эффект процедуры и просчитать длительность курса.
Выжечь зловредных пришельцев
«Из-за высокой бактериальной нагрузки полученные в полевых условиях раны тяжело поддаются заживлению, — рассказывает аспирант МИФИ Андрей Уденеев. — В молекулярной биологии известен так называемый эффект кворум-сенсинга, в данном случае выражающийся в образовании колоний микроорганизмов — биопленок толщиной до нескольких миллиметров, которые высокорезистентны к лекарствам и препятствуют проникновению антибиотиков. Так научился защищаться целый класс микроорганизмов, в который входят и широко распространенные штаммы золотистого стафилококка или синегнойной палочки. Из-за них раны гноятся и требуют изнурительно долгого лечения».
Механизм убийственного действия фотонов на чужеродные колонии в живых тканях в точности не известен и остается объектом исследований. Ученые склоняются к тому, что дело в химическом характере окислительного процесса, инактивирующего биологические структуры. Правда, оружие это «бинарное». Помимо пучка света к бактериальной клетке необходимо доставить специфический препарат — фотосенсибилизатор.
«После поглощения кванта света молекулой фотосенсибилизатора на микроуровне возможны два процесса (в объеме пораженной раневой ткани они протекают параллельно), — объясняет Андрей Уденеев. — молекула начинает флуоресцировать и передает избыточную энергию соседнему кислороду. Его возбужденные молекулы, в свою очередь, вступают в реакцию с окружением и окисляют все, до чего могут дотянуться, включая оболочки бактерий. Что нам и нужно! К счастью, резистентность к фотодинамической терапии у бактерий крайне маловероятна».
Красная машина
Предметом научного поиска на переднем крае медицинских исследований остается подбор фотосенсибилизатора и опорной длины волны фотонов, совместно препятствующих разрастанию в живой ткани опухолей, в том числе злокачественных. Свет в этом случае доставляется к мишени через световод, а фотосенсибилизатор вводится внутривенно. При работе с раной все проще: препарат распыляют на раневую поверхность, и фотоны видимого спектра сами преодолевают несколько миллиметров ткани.
Фотосенсибилизаторов медицине известно несколько. Мифисты апробировали вещества хлоринового ряда: фотодитазин, фоторан-е6, радахлорин.
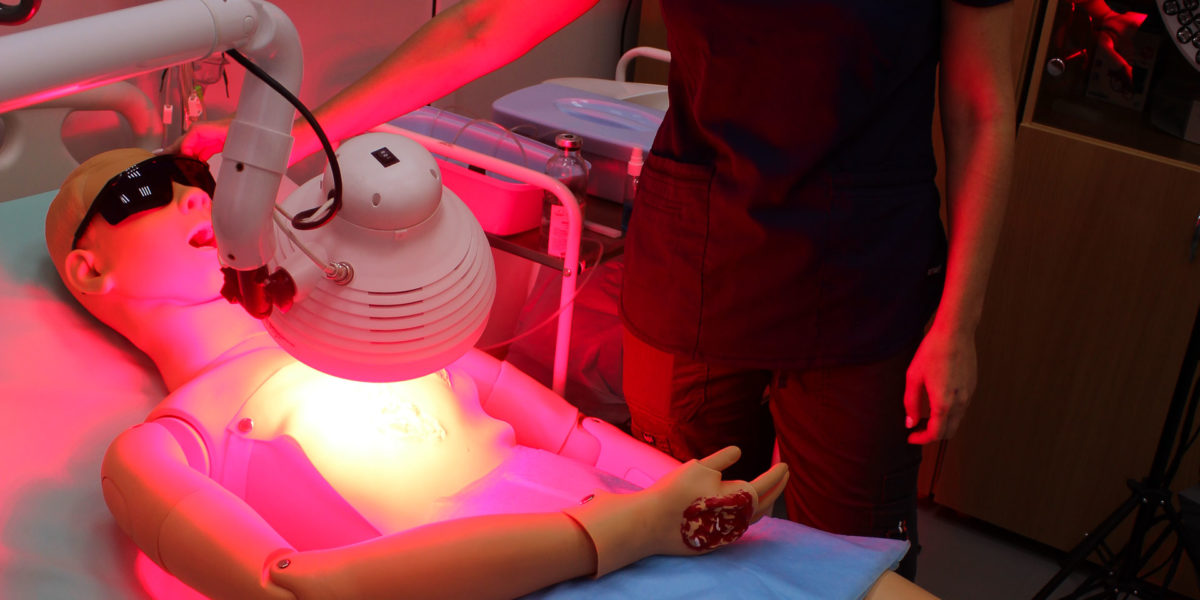
Лучше всего проникают в рану лучи с длиной волны около 660 нм из красной границы видимого диапазона. В прототипе установки, созданной мифистами совместно с отечественным медицинским предприятием, использовали светодиоды общего применения. Запитывается аппарат от бытовой сети переменного тока, энергии потребляет примерно столько же, сколько мощная лампа накаливания.
«Для медицинских процедур оптимальным оказалось фокусное расстояние 15 см, при котором наш аппарат выдает пучок широкого захвата: пятно эффективного облучения простирается на 200 см2, — говорит доцент кафедры лазерных микро-, нано- и биотехнологий Нина Калягина. — Интенсивность света — несколько сотен милливатт на квадратный сантиметр — врачей вполне устраивает».
Мостик к тераностике
Конечно, аналоги у этого устройства есть. Но российским ученым и инженерам удалось добиться потока световой энергии на порядок больше, чему у аппаратов, что представлены на мировом рынке. А это означает сокращение продолжительности лечения — и сеанса, и курса. Нина Калягина конкретизирует: по результатам клинических испытаний в Первом Московском государственном медицинском университете им. Сеченова и ряде госпиталей можно говорить о достаточном эффекте после нескольких сеансов длительностью до 10 минут у подавляющего большинства пациентов. Но это отнюдь не единственное преимущество.
«Молекулы фотосенсибилизаторов заряжены, — продолжает Андрей Уденеев. — Молекулы патогенных биопленок, как правило, тоже. Чтобы избавиться от дополнительных затруднений при доставке действующего вещества из-за взаимного отталкивания, мы разработали и апробировали фотосенсибилизатор в виде электрически нейтральной жидкой эмульсии. Но и это еще не все! Помните, мы говорили о флуоресценции фотосенсибилизатора в патогенных биоструктурах при облучении светом? Оказывается, этот процесс можно использовать для диагностики состояния пораженной ткани. В первом приближении, когда фотосенсибилизатор под действием активного кислорода выгорел и больше не флуоресцирует, процедуру можно заканчивать. Поэтому в нашей установке помимо красного излучателя присутствует оптический анализатор флуоресценции фотосенсибилизаторов. Камера регистрирует свечение в тех или иных точках, показывая врачам, насколько успешно идет лечение, на какой оно стадии».
Как выяснилось при опытной эксплуатации устройства цифрового видеоконтроля и в клинических испытаниях всей установки, по этой схеме можно регистрировать флуоресценцию не только от фотосенсибилизаторов, но и от других индикаторов лечебного процесса — например, эндогенных флуорофоров, образующихся в организме при введении лекарственного препарата. Эту существенную для всей установку «добавку» назвали универсальным диагностическим модулем. Вместе с ним разработка фактически прокладывает мостик от терапии к фототераностике — набору приемов, позволяющих сочетать лечение с диагностикой.







